Goedkeuring alpelisib door FDA
Naast sirolimus is er nu ook alpelisib

Het medicijn Vijoice® (alpelisib) van Novartis is onlangs (6 april) goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) voor de behandeling van patiënten van twee jaar en ouder met een ernstige vorm van PIK3CA-gerelateerde overgroeispectrum (PROS). Tot nu toe waren de enige behandelmogelijkheden voor deze patiënten chirurgische ingrepen of interventieradiologische procedures.
Vijoice is de eerste door de FDA goedgekeurde behandeling voor patiënten met PROS, een spectrum van zeldzame aandoeningen die worden gekenmerkt door overgroeiingen en bloedvatafwijkingen en die naar schatting 14 mensen per miljoen treffen. De overgroei-aandoeningen die door PIK3CA-mutaties worden veroorzaakt en onder PROS vallen zijn onder meer: KTS, CLOVES-syndroom, ILM, MCAP/M-CM, HME, HHML, FIL, FAVA, macrodactylie, musculaire HH, FAO, CLAPO-syndroom en epidermale nevus, benigne lichenoïde keratose of seborrheïsche keratose.
Werking alpelisib
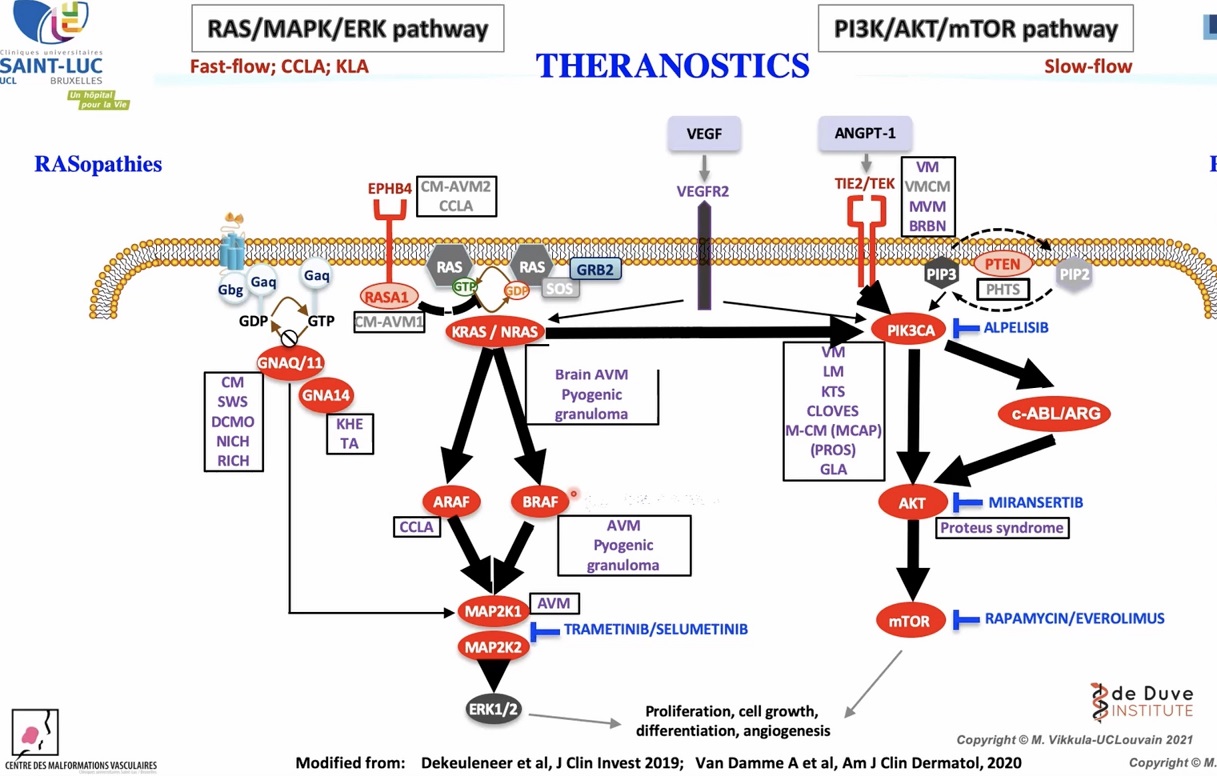
Vijoice is een kinaseremmer die zeldzame overgroei-aandoeningen behandelt die worden veroorzaakt door de effecten van PIK3CA-mutaties. Vijoice werkt door het remmen van de PIK3K-route, voornamelijk de PIK3K-alfa-isovorm.
Kwaliteit van leven
“De goedkeuring van de eerste behandeling voor PROS biedt hoop op een betere kwaliteit van leven voor patiënten en families die getroffen zijn door deze zeldzame aandoeningen,” zegt Kristen Davis, executive director van CLOVES Syndrome Community.
PROS-aandoeningen kunnen de kwaliteit van leven aantasten en een reeks lichamelijke, emotionele en sociale uitdagingen voor patiënten en hun families met zich meebrengen, variërend van functionele gevolgen en ontwikkelingsachterstanden tot chronische pijn, mobiliteitsproblemen en gevoelens van isolement. De behandeling van PROS kan lastig zijn, waarvoor samenwerking van een multidisciplinair team nodig is. Patiënten en artsen hadden tot nu toe alleen toegang tot behandelingen die gericht waren op symptoombestrijding.
EPIK-P1 een overzichtsonderzoek
De goedkeuring van de FDA is gebaseerd op de resultaten van EPIK-P1, een retrospectief overzichtsonderzoek dat aantoonde dat patiënten die werden behandeld met Vijoice een verminderd doelwitlaesievolume en verbetering van PROS-gerelateerde symptomen ervoeren. De meest voorkomende bijwerkingen van enige graad waren diarree (16%), stomatitis (16%), en hyperglykemie (12%). Een bijwerking van graad 3/4 was cellulitis (4%).
Wachten op goedkeuring door EMA
Vijoice is niet goedgekeurd voor gebruik buiten de Verenigde Staten. Patiënten in Europa zullen dus moeten wachten op de goedkeuring door het European Medicines Agency (EMA). Alpelisib is wel op 26 maart 2021 door de EMA aangewezen als weesgeneesmiddel voor de behandeling van PIK3CA-gerelateerd overgroeispectrum in de Europese Unie. Dit betekent dat de ontwikkelaar wetenschappelijke en regelgevende steun zal krijgen van EMA om zijn geneesmiddel tot het stadium te brengen waarin hij een vergunning voor het in de handel brengen kan aanvragen. De aanduiding als weesgeneesmiddel betekent niet dat het geneesmiddel beschikbaar of toegelaten is voor gebruik. Voor alle geneesmiddelen, ook voor weesgeneesmiddelen, moet een vergunning worden aangevraagd voordat ze in de EU in de handel kunnen worden gebracht en aan patiënten ter beschikking kunnen worden gesteld. Tijdens de ontwikkeling van het geneesmiddel kunnen artsen patiënten laten deelnemen aan klinische proeven waarin het geneesmiddel wordt onderzocht.





