
Professor Mikka Vikkula legt in zijn lezing uit hoe wetenschappers de oorzaak van vasculaire anomalieën (waaronder CMTC) proberen te achterhalen. De wetenschappers zoeken in het DNA van patiënten naar mutaties die de oorzaak van deze aandoeningen kunnen zijn. Tot nu toe zijn genen van 11 verschillende erfelijke vasculaire anomalieën gevonden. Deze genen hebben (een) mutatie(s) waardoor het gen -of eigenlijk het product, het eiwit- niet goed functioneert. Van CMTC is nog geen specifiek gen gevonden.
Vikkula werkt al meer dan 20 jaar op het gebied van vasculaire anomalieën. Na zijn opleiding als arts raakte hij zeer geïnteresseerd in de humane genetica tijdens zijn postdoc-periode (1993-97) aan de Harvard Medical School, Boston, USA. Hij wilde zijn werk daarna graag voortzetten en startte in 1997 een nieuwe onderzoeksgroep gericht op de humane genetica aan het De Duve Instituut in Brussel. Een van de onderwerpen waar hij zich mee bezighoudt is vasculaire anomalieën.
“Zo’n 20 jaar geleden werden alle laesies een angioom of een hemoangioom genoemd. Momenteel kunnen we 40 verschillende soorten vasculaire anomalieën onderscheiden”, zegt Vikkula.
“Een precieze diagnose is belangrijk om de ontwikkeling van de vasculaire anomalie te begrijpen, de best mogelijke behandeling te kunnen aanbieden en om de anomalie uiteindelijk te voorkomen,” benadrukt hij.
Er zijn veel verschillende soorten afwijkingen en veel daarvan zitten in de huid, maar ze kunnen ook in elk inwendig orgaan voorkomen. Vasculaire anomalieën kunnen erfelijk zijn of niet-erfelijk. De meeste zijn niet-erfelijk. Naast dat er meer kennis is gekomen over deze aandoeningen zijn er de laatste jaar ook steeds meer gespecialiseerde centra opgezet. Dit zijn multidisciplinaire centra waar artsen van verschillende disciplines samenwerken.
Om de rest van zijn verhaal te kunnen volgen legt hij eerst wat uit over DNA.
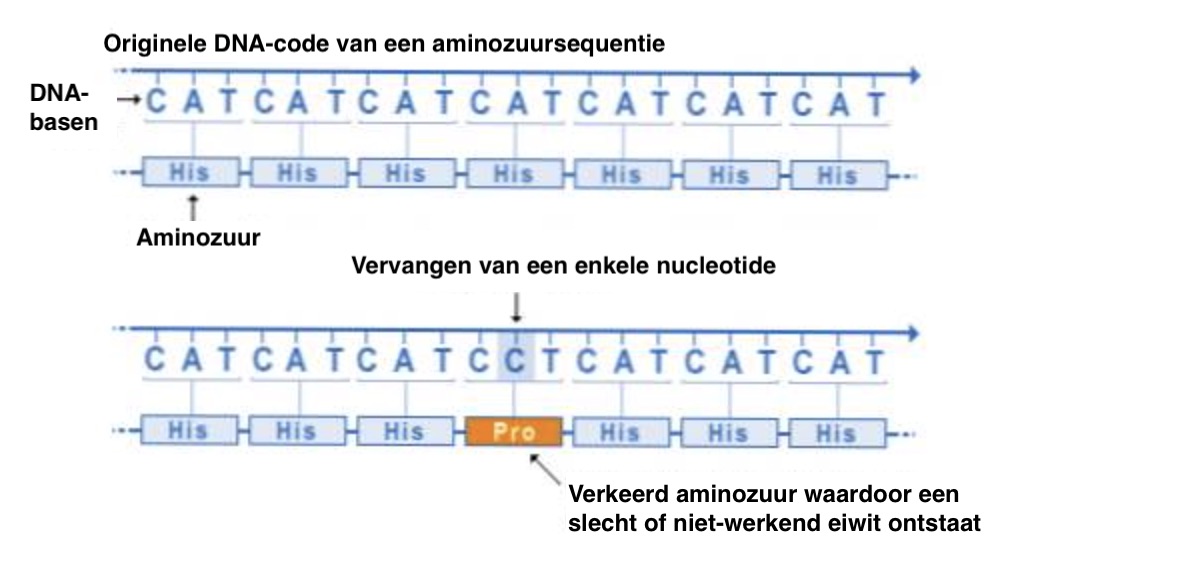 Hoe kunnen we mutaties in het DNA opsporen?
Hoe kunnen we mutaties in het DNA opsporen?Elke keer dat een cel zich deelt, moet hij een volledige kopie van het DNA in de cel maken. Dit kopieerproces is een bron van fouten. Om de fouten te vinden moeten we de volgorde van het DNA bepalen (om de DNA-code te lezen). Om de volgorde van ons DNA te kunnen bepalen, moet het eerst in kleine fragmenten van 100 nucleotiden worden geknipt. De sequencingmachine kan dan de volgorde van de nucleotides (letters) van het DNA bepalen. Daarna moeten de fragmenten in de juiste volgorde worden gezet om het hele DNA te reconstrueren. In het sequentiewerk maar ook in het reconstitutiewerk kunnen extra fouten optreden, maar er zijn manieren om het te verbeteren en de fouten te verminderen. Daarop gaan we hier niet verder in.
Elk individu heeft een iets ander DNA dan een ander individu, daarom zijn we allemaal anders. De meeste verschillen in DNA zijn normale variaties en veroorzaken geen ziekte. Slechts zeer weinig variaties kunnen de oorzaak zijn van een ziekte. Dus hoe vind je variaties (mutaties) die vasculaire anomalieën veroorzaken als tussen twee individuen 5000.0000 (5 miljoen) varianten kunnen voorkomen? Om het werk te vereenvoudigen moet je inzoomen op het DNA dat de grootste kans heeft om de ziekte-veroorzakende mutatie te bevatten.

In het resterende DNA moet je kijken naar de functies van de genen waarin de variaties voorkomen. Een gen is een stukje DNA dat codeert voor een eiwit dat een functie heeft. In dit onderzoek zoeken we naar genen die coderen voor eiwitten die de vasculaire ontwikkeling sturen. Zijn er al gegevens bekend over genen betrokken bij de vasculaire ontwikkeling? Op deze manier kan je proberen het betreffende gen te vinden. Sinds 1994 zijn genen gevonden van 11 verschillende erfelijke vasculaire afwijkingen gevonden. We kunnen nu testen op deze genetische afwijkingen.
Lees meer:
https://medlineplus.gov/genetics/understanding/mutationsanddisorders/genemutation/[
Eiwitten (met onderlinge routes) die betrokken zijn bij diverse cellulaire processen (waaronder vorming van nieuwe vaten). De namen van inhibitoren zijn in blauw weergegeven.
Vaak zorgt een mutatie ervoor dat het gen zijn functie verliest of minder actief wordt, zodat een ziekte/afwijking ontstaat. TIE2 is wat dat betreft een uitzondering: bepaalde mutaties in dit gen veroorzaken een hyperactivatie.
In 2009 hebben we voor het eerst aangetoond dat een niet-erfelijke vaatafwijking kan worden veroorzaakt door enkelvoudige somatische mutaties (d.w.z. mutaties die alleen aanwezig zijn in de aangedane (misvormde) gebieden). Ze worden niet van de ene generatie op de andere overgedragen. Sindsdien is men niet alleen gaan kijken naar de zeldzame erfelijke vormen, maar ook naar de sporadisch voorkomende vaatafwijkingen. Zo werd in 2011 de oorzaak ( somatische mutatie) van het Proteus syndroom gevonden en in 2013 van CLOVES. Verschillende ziekten zijn nu geassocieerd met verschillende somatische mutaties.
Bijvoorbeeld TIE2. Dit is een receptor aan de buitenkant van een celmembraan (zie plaatje boven). De mutatie in TIE2 maakt het te actief. Als het geactiveerd wordt, zal het te veel signaal in de cel afgeven. Een remmende stof of inhibitor zou het signaal kunnen vertragen of afremmen. Gelukkig zijn er verschillende inhibitoren ontwikkeld voor de verschillende eiwitten die op het gebied van kanker worden onderzocht. We gebruiken deze inhibitoren nu voor vasculaire anomalieën. De namen van de inhibitoren zijn in het plaatje in blauw weergegeven. Rapamycine/sirolimus is een remmer van mTOR (lees meer op: https://www.cmtc.nl/pedia/pedia-overig/sirolimus/). Het bevindt zich nu in een klinische fase 3 van een klinische studie. Dat betekent dat er getest wordt op de uiteindelijke dosering op bruikbaarheid en effectiviteit bij grotere aantallen patiënten. Dit wordt vergeleken met een bestaand middel of placebo. Ook wordt gekeken naar de veiligheid op korte en langere termijn.
CMTC-patiënten hebben bij de geboorte rode lesies die (deels) vervagen als ze ouder worden. Er is atrofie (verschrompeling/afname) op de huid waardoor deze aandoening zich onderscheidt van andere anomalieën. Het is vergelijkbaar met capillaire misvormingen. Om het gen voor CMTC te vinden is er weefsel uit het aangetaste gebied en het bloed nodig. Sommige capillaire misvormingen hebben een PIK3CA-mutatie, sommige een GNAQ/GNA11-mutatie. Deze mutaties zien we niet in CMTC. Het zou een somatische mutatie kunnen zijn. Als we het gen of de genen vinden geeft het ons een diagnostisch hulpmiddel om CMTC te identificeren en het onderliggende mechanisme te begrijpen. Uiteindelijk kunnen we dan een therapie ontwikkelen.
door Dr. Lilian Vermeer





