
De wetenschap is al lang op zoek naar medicatie voor vasculaire malformaties (bloedvatziekten). Het medicijn sirolimus lijkt een gunstig effect te hebben. Dat kwam naar voren uit studies met ernstige vasculaire anomalieën. Er loopt momenteel een studie waarbij kinderen en volwassen patiënten met complexe vasculaire malformaties die slecht reageren op de standaardbehandeling behandeld worden met sirolimus.
Prof. dr. Laurence Boon en Prof. dr. Miikka Vikkula (één van onze adviseurs) zijn ook betrokken bij deze ontwikkeling. Zij publiceerden op 15 juni 2020 een overzichtsartikel ‘New and Emerging Targeted Therapies for Vascular Malformations’ in het tijdschrift American Journal of Clinical Dermatology. Zij geven daarin een overzicht van wat er tot nu toe bekend is over vasculaire malformaties en het effect van de behandeling van sirolimus en andere specifieke medicijnen. Onder de kop ‘Nieuwe gerichtere therapieën voor vasculaire malformaties’ (scrol naar beneden op deze pagina) is een beknopte samenvatting gegeven van dit artikel.
Binnen Facebook is een aparte privégroep beschikbaar ‘Sirolimus For Complex Vascular Anomalies’:
Het eerste klinische gebruik van sirolimus was om afstoting van een niertransplantatie te voorkomen en is in dit verband uitgebreid bestudeerd. Het werd in 1999 en 2001 door de Amerikaanse Food and Drug Administration en het Europees Geneesmiddelenbureau goedgekeurd voor deze indicatie. Sirolimus behoort tot de ‘Mammalian target van rapamycine (mTOR) remmers’. Het wordt toegepast in een groot aantal ziekten zoals weke delen en bot sarcoom, lymfoom, neuro-en-docriene tumoren en tubereuze sclerose. Op dit moment (juni 2020) is sirolimus niet goedgekeurd voor de behandeling van enige vasculaire malformatie. Het is wel gebruikt uit medeleven (compassionate use setting) voor patiënten met complexe levensbedreigende vasculaire anomalieën. Een fase III klinische studie (VASE) is momenteel aan de gang in Europa.
Sirolimus grijpt in op een belangrijke signaalroute in ons lichaam. Het is een remmer van de zogenaamde mTOR-signaleringsroute. Deze is belangrijke bij allerlei cellulaire processen zoals celgroei, -deling en -overleving. In deze route bevinden zich onder andere de volgende eiwitten: TIE2-> PI3K- (PTEN) -> AKT-> . Mutaties in TIE2, PI3K, PTEn of AKT kunnen de route (over)activeren.
De laatste twintig jaar is er veel kennis bij gekomen over de genetica en de moleculaire mechanismen achter het ontstaan van vasculaire malformaties. Tot nog toe werden vasculaire malformaties vooral behandeld met behulp van chirurgische ingrepen en embolisatie (afsluiten van een vat). Door de grotere kennis over de achterliggende mechanismen probeert men nu met specifieke medicijnen gericht in te grijpen op die mechanismen. Vooral sirolimus, ook wel rapamycine genoemd, is veel onderzocht en lijkt een gunstig effect te hebben. Tot nog toe is het vooral ingezet bij ernstige vasculaire anomalieën.
De oorzaak van het ontstaan van vasculaire anomalieën lijkt vooral te komen door een afwijkende signaaloverdracht in vasculaire endotheelcellen*. Signaaloverdracht zorgt ervoor dat allerlei opdrachten binnen de cel worden doorgegeven, zoals starten met celdeling, eiwitsynthese, beweging, doodgaan (of niet). De signaaloverdracht wordt verzorgd door paden/routes van voornamelijk eiwitten. Die eiwitten geven aan elkaar het signaal door. Als een eiwit niet (goed) werkt of juist te goed werkt doordat het afwijkend is, heeft dat gevolgen voor de signaaloverdracht. De signaaloverdracht stopt, gaat te traag of te hard van start. Daardoor kan er bijvoorbeeld een te lage of te hoge mate van celdeling optreden.
De afwijkende signaaloverdracht komt door mutaties in genen die zorgen voor activatie van de signaaloverdracht. De meeste vasculaire malformaties worden veroorzaakt door mutaties in genen die zorgen voor activatie van twee belangrijke intracellulaire routes (pathways) van signaaloverdracht. Het zijn de zogenaamde PI3K/AKT/mTOR pathway en de RAS/MAPL/ERK pathway. Beide pathways zijn betrokken bij veel cellulaire processen, zoals celdeling en -groei (celcyclus), celclyclusregulatie, proliferatie, eiwitsynthese en celoverleving. Beide pathways zijn ook betrokken bij het ontstaan van kanker.
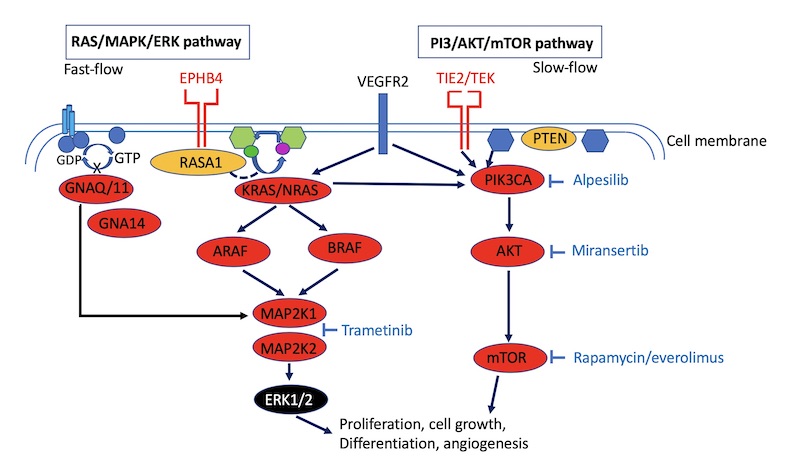
Zestig procent van de vasculaire malformaties (VMs) hebben een activerende mutatie (gain-of-function) in het TIE2-eiwit. TIE2 maakt gebruik van de mTOR pathway. Als de mTOR pathway wordt aangezet door TIE2 gaat er groei optreden van endotheelcellen. Zo’n activerende mutatie zorgt ervoor dat het effect van TIE2 sterker of zelfs abnormaal wordt. Dus in dit geval kan dat leiden tot abnormale groei van endotheelcellen. Twintig procent van de VMs hebben een activerende mutatie in het PIK3CA-gen dat zich in de mTOR pathway bevindt.
In de ISSVA-classificatie (https://www.issva.org/classification) van de verschillende soorten malformaties is vermeld met welke mutatie welke aandoening geassocieerd is (voor zover bekend). Dus bijvoorbeeld de ondersoorten cutaneomucosal VM (VMCM), common VM, multifocal VM en blue rubber bleb nevus (BRBN) zijn allen geassocieerd met TIE2 mutaties.
De meest voorkomende mutaties in het PIK3CA-gen zijn geassocieerd met kanker en lymfatische malformaties en overgrowth syndromes, zoals Klippel-Trenaunay syndrome, congenital lipomatous overgrowth, vascular malformation, epidermal nevi, scoliosis/skeletal en spinal syndrome (CLOVES), en megalencephaly-capillary malformation.
Sirolimus is een directe remmer van mTOR, en blokkeert de signalering (Figuur 1) en eiwitsynthese, wat resulteert in antitumorale en antiangiogene effecten. De eerste beschrijving van een significante klinische respons van sirolimus bij vasculaire malformaties was in een studie met zes patiënten met complexe levensbedreigende vasculaire anomalieën [2]. Het betrof patiënten met KHE (kaposiform hemangioendothelioma) en Kasabach-Merritt fenomeen (KMP) met ernstige coagulopathie (ongecontroleerde bloedingen) en hoog-output hartfalen dat oploste na behandeling met sirolimus. Een patiënt met capillair-lymfatische VM, en vier patiënten met diffuse microcystische LM’s met een abnormale toename van de hoeveelheid vocht in de borstholte die borstkasbuisjes nodig hadden die verwijderd konden worden na behandeling met sirolimus.
De grootste (fase II) studie tot nog toe, is uitgevoerd in 2016 [3]met 61 patiënten met complexe vasculaire anomaliën (met complicaties zoals ongecontroleerde bloedingen, chronische pijn, terugkerende cellulitis, zweren, ingewanden- en bottenproblemen, hartfalen). 57 waren geschikt voor verdere evaluatie. 83 procent had een gedeeltelijke respons na 6 maanden, 85 procent had een gedeeltelijk respons na 12 maanden. In het algemeen gezien hadden deze patiënten een significante verbetering in kwaliteit van leven.
Er loopt nu een studie (fase III-studie (VASE) waarbij sirolimus wordt geëvalueerd bij kinderen en volwassen patiënten met complexe vasculaire malformaties (van de aderen) die slecht reageren op de standaardbehandeling (EudraCT Number: 2015-001703-32). Patiënten krijgen sirolimus gedurende 2 jaar, maar kunnen na afloop van de behandeling opnieuw behandeld worden in geval van terugval van de symptomen.
De mTOR-remmer sirolimus is dus tot nog toe het meest uitvoerig bestudeerde geneesmiddel in deze context. Veelbelovende resultaten van verschillende fase I- en II-prospectieve studies en van retrospecifiek onderzoek hebben geleid tot een fase III klinisch onderzoek (VASE) dat momenteel in Europa wordt uitgevoerd. Bewijs voor het succesvolle gebruik van andere gerichte verbindingen bij andere indicaties, zoals de PIK3CA-remmer alpelisib, de MEK-remmer trametinib en de monoklonale anti-VEGF-antilichaam bevaci-zumab, neemt ook toe, maar moet verder zorgvuldig worden bestudeerd.
Aangezien sirolimus en andere remmers ingrijpen op belangrijke processen zoals celdeling en -groei, celclyclusregulatie, proliferatie, eiwitsynthese en celoverleving zijn er ook de nodige bijwerkingen. De meest voorkomende bijwerkingen zijn: hoofdpijn, vermoeidheid, huiduitslag, ontsteking van mondslijmvlies, misselijkheid en diarree. De dosis is erg belangrijk. De mTOR pathway is ook een centrale regulator van het immuunsysteem. Als je dat onderdrukt, is het van groot belang om bijwerkingen zoals infecties in de gaten te houden.
Samengesteld door Lilian Vermeer.
[1] Van Damme A, Seront E, Dekeuleneer V, Boon LM, Vikkula M. New and Emerging Targeted Therapies for Vascular Malformations, American Journal of Clinical Dermatology, 15 juni 2020
https://doi.org/10.1007/s40257-020-00528-w
[2] Hammill AM, Wentzel MS, Gupta A, Nelson S, Lucky A, Elluru R, et al. Sirolimus for the treatment of complicated vascular anomalies in children. Pediatr Blood Cancer. 2011;57:1018–24.
[3] Adams DM, Trenor CC 3rd, Hammill AM, Vinks AA, Patel MN, Chaudry G, et al. Efficacy and safety of sirolimus in the treatment of complicated vascular anomalies. Pediatrics. 2016;137(2):e20153257.